新版《药品技术转让注册管理规定》核心解读 优化路径,强化监管,促进创新

为适应我国医药产业高质量发展的新形势,国家药品监督管理部门近期对药品技术转让的相关规定进行了修订和完善。新版规定旨在进一步规范药品技术转让行为,优化审评审批流程,同时强化全生命周期监管,以激发市场活力,促进医药技术创新与成果转化。
一、 明确技术转让范围与类型,界定更清晰
新版规定对可进行技术转让的药品情形进行了更细致的划分,主要包括:
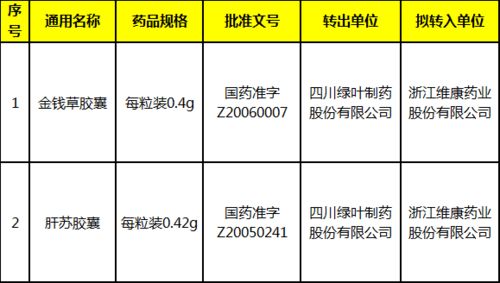
1. 持有方变更:药品批准文号或进口药品注册证持有方(所有权)的转移,是最常见的技术转让形式。
2. 生产场地变更:药品生产地址的迁移,通常涉及生产工艺、质量控制的衔接与验证。
3. 联合持有:新增了对联合持有情形的规范,为合作研发成果的产权分配与商业化提供了明确路径。
规定明确排除了某些特定情形(如濒临注销的文号),确保转让行为服务于产业资源优化整合,而非单纯“炒卖”文号。
二、 优化注册申请程序,提升审评效率
新版规定显著优化了技术转让的注册申请流程:
- 简化申请资料:根据转让类型的不同,科学厘清需要提交的申报资料项目,减少重复和不必要的资料提交,减轻申请人负担。
- 明确审评时限:对技术转让注册申请的审评时限作出了更明确的规定,增强了流程的可预期性。
- 强调沟通交流:鼓励申请人在关键阶段(如工艺验证前)与监管机构进行沟通,提前解决潜在问题,提高申请成功率。
三、 强化全过程质量风险管理,压实主体责任
新版规定的核心精神之一是强化质量监管,确保技术转让过程中药品质量持续稳定:
- 工艺验证与稳定性对比:要求受让方必须完成系统的工艺验证,并提供与转让方产品质量的对比研究资料,尤其是关键质量属性和稳定性数据,以证明技术转移后产品质量的一致性。
- 强调药品上市许可持有人责任:无论是转让方还是受让方,作为药品上市许可持有人(MAH),都必须对药品的全生命周期质量承担主体责任。技术转让协议中必须明确质量责任划分,并向监管部门报告。
- 加强上市后监管:技术转让获批后,药品将纳入基于风险的上市后监管体系,包括可能的监督检查、抽样检验和不良反应监测。
四、 鼓励创新与资源整合,服务产业升级
新版规定的导向十分明确:
- 促进真正有价值的技术流动:通过细化规定,引导技术转让服务于有实质改进的创新药、改良型新药以及市场需求大但产能不足的品种,推动优势资源向优势企业集中。
- 支持MAH制度全面实施:为MAH制度下,研发机构与生产企业之间灵活多样的合作模式(如委托生产、权益转让)提供了规范的办理通道,促进研发与生产的专业化分工。
- 规范跨境技术转让:对进口药品境内持有人的变更或生产场地的跨国转移,规定了相应的技术要求与程序,与国际监管实践进一步接轨。
****
新版药品技术转让规定体现了“放管服”改革的深化,在“放”的方面优化流程、激发活力,在“管”的方面严守质量安全底线、强化主体责任。对于药品研发机构、生产企业及MAH而言,新规既带来了更便捷的技术转化路径,也提出了更严格的质量管理要求。企业需深入理解新规精髓,在技术转让前进行充分的技术评估与合规准备,建立健全质量管理体系,从而在合规框架下高效实现技术价值,共同推动我国医药产业迈向创新驱动的高质量发展新阶段。
如若转载,请注明出处:http://www.kanhkj.com/product/60.html
更新时间:2026-02-25 14:59:56